Genética Molecular Humana
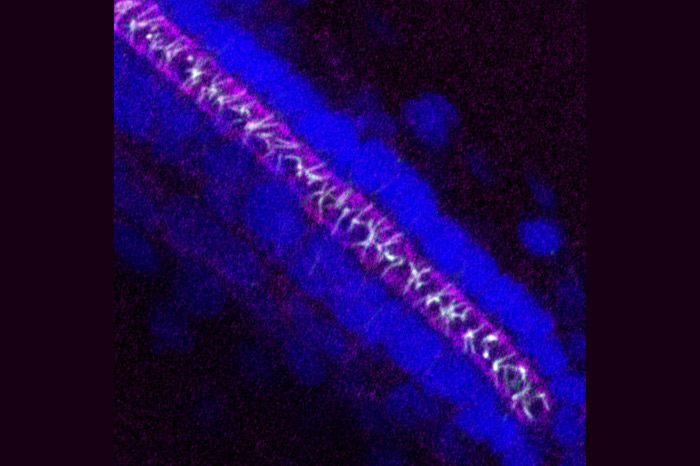
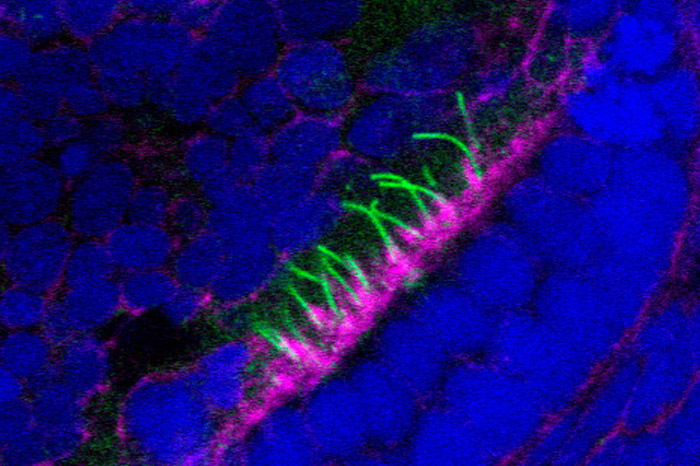
Estudiamos diferentes aspectos relacionados con la biología de las cilias, especialmente las primarias, que están presentes en la gran mayoría de células humanas y que participan en diversos procesos como recepción y transducción de señales, actuando como antenas regulando la fisiología celular en coordinación con el entorno. Se ha demostrado que su disfunción da lugar a una serie de enfermedades humanas conocidas colectivamente como ciliopatías. Entre ellas, estudiamos genes y proteínas que, cuando están mutadas, causan el Síndrome de Bardet-Biedl (BBS), una ciliopatía caracterizada principalmente por obesidad, polidactilia, retardo mental, degeneración de la retina, malformaciones renales y gonadales que a menudo incluyen características adicionales como asma, diabetes, anosmia y enfermedades congénitas de corazón.
Nos centramos en el estudio de distintas proteínas asociadas a BBS así como otras proteínas ciliares, y realizamos tanto ensayos in vitro como in vivo mediante la generación de modelos animales. Con ello apuntamos, por un lado, a aumentar el conocimiento sobre la biología básica de las cilias como organelos y, por otro lado, a entender la base celular y molecular de distintos aspectos clínicos que caracterizan a BBS y otras ciliopatías. En este contexto, un esfuerzo importante del laboratorio está enmarcado dentro del Programa InDICyO (Investigación en Diabetes, Inflamación, Enfermedades Cardiovasculares y Obesidad), enfocándonos en entender el rol de las cilias y distintas proteínas de interés en temas relacionados principalmente con el desarrollo de obesidad y aterosclerosis.
Integrantes


Florencia Irigoin, PhD
Investigadora adjunta senior honoraria
Facultad de Medicina, Udelar
firigoin@pasteur.edu.uy










Líneas de investigación
CCDC28B y las proteínas BBS en la regulación de ciliogénesis y largo de las cilias.
En el laboratorio hemos venido caracterizando el rol biológico de proteínas BBS y una proteína asociada al síndrome denominada CCDC28B (por “coiled-coil domain containing protein 28B”). En pacientes, originalmente reportamos que una disminución en los niveles de CCDC28B, en un contexto con mutaciones en genes BBS, resulta en una presentación más severa del síndrome. CCDC28B interactúa físicamente con un número de proteínas BBS y nosotros hemos demostrado que es un nuevo regulador del largo de las cilias tanto en células como in vivo en el modelo de pez cebra. Sabemos que la función de CCDC28B en la cilia depende, al menos en parte, de su interacción con SIN1 y el motor molecular kinesina 1. Actualmente continuamos caracterizando CCDC28B para entender su mecanismo de acción y así comprender procesos relacionados con el control de la función ciliar.
Cilia targeting: similitudes con el proceso de transporte nuclear.
Las cilias son organelos conservados que si bien protruyen de la membrana plasmática y su interior está conectado con el citosol, poseen una composición particular y diferente que es importante para su función. Por ejemplo, distintos receptores y mediadores de vías de señalización se concentran en la cilia y el ingreso de moléculas al organelo está altamente regulado. Sin embargo, los mecanismos involucrados en dirigir moléculas a las cilias así como su ingreso no está del todo claro. Distintas líneas de evidencia muestran una alta similitud con la importación de proteínas al núcleo. En este contexto, hemos venido estudiando el rol de la maquinaria de importación nuclear en el transporte de proteínas a la cilia, estudiando proteínas que pueden localizarse en ambos compartimentos. En particular nos centramos en Gli2, un factor de transcripción de la vía de Hedgehog, que varía su localización como parte integral de la activación de la vía, y mostramos que tanto para ingresar al núcleo como a la cilia utiliza importinas, si bien no las mismas. Continuamos estudiando este proceso para entender el mecanismo en profundidad.
Proteínas asociadas al Síndrome de Bardet-Biedl (BBS) en el tráfico intracelular.
La caracterización funcional de proteínas BBS nos ha llevado a descubrir que en muchos casos cumplen funciones que exceden a las cilias. Por ejemplo, hemos demostrado que BBS7 es capaz de ingresar al núcleo donde modula la actividad de RNF2, una proteína remodeladora de cromatina. De esta manera, defectos en BBS7 resultan en cambios en expresión génica. Más recientemente también hemos documentado que CCDC28B necesita entrar al núcleo para cumplir su rol en la cilia, si bien todavía desconocemos el mecanismo. En colaboración con la Dra. Norann Zaghloul en la Universidad de Maryland, USA, hemos mostrado que las proteínas BBS no solo transportan proteínas a la cilia sino que tienen un rol más amplio en el transporte intracelular y la secreción de al menos algunas proteínas. Por ejemplo, hemos mostrado que BBS4 es requerida para la correcta secreción de FSTL1, una función que pensamos es relevante para entender el desarrollo de BBS.
El rol de las proteínas BBS y las cilias en el desarrollo de fenotipos asociados a ciliopatías.
Entender el rol biológico de proteínas BBS y CCDC28B es fundamental para comprender los mecanismos que subyacen al desarrollo de BBS y los fenotipos asociados. Por lo tanto, además de intentar disecar la función de estas proteínas a nivel celular y molecular, también evaluamos su función en modelos relevantes a la patología. Por ejemplo, hemos estudiado el rol de las cilias en el desarrollo de la retina utilizando el pez cebra como modelo de estudio. Actualmente estamos enfocados en el estudio de las proteínas BBS y las cilias en el proceso de adipogénesis y el desarrollo de obesidad. Por ejemplo, nuestros datos muestran que defectos en BBS4 llevan a una reducción en la secreción de FSTL1 (como ya mencionamos) y reportamos a FSTL1 como un nuevo regulador de la ciliogénesis y la adipogénesis. Estos estudios los estamos llevando adelante en una colaboración con el Dr. Escande en el marco del programa institucional Investigación en Diabetes, Inflamación, Enfermedades Cardiovasculares y Obesidad (INDICyO).
Proyectos
2018-2019 – Estudio comparativo del rol de BBS4 y ALMS1 en adipogénesis y la obesidad en ciliopatías. Responsable: Victoria Prieto-Echagüe. Ministerio de Educación y Cultura, Dirección para el desarrollo de la ciencia y el conocimiento.
2018-2020 – Movimiento de proteínas a la cilia: Contribuciones al entendimiento de un aspecto básico de la biología de este organelo. Responsable: Florencia Irigoín. ANII, Fondo Clemente Estable 2017.
- 2017-2019 – Estudio funcional de la interacción CCDC28B-BBS4 y su impacto en la patogénesis del síndrome de Bardet-Biedl. Responsables: Florencia Irigoín y José L. Badano. Universidad de la República, Comisión sectorial de Investigación Científica (CSIC I+D 2016).
- 2016-2017 – FOCEM, INDICyO
- 2013-2015 – Entendiendo el rol de CCDC28B durante el proceso de ciliogénesis y la regulación del complejo mTORC2. Responsables: José L. Badano y Florencia Irigoín. Universidad de la República, Comisión sectorial de Investigación Científica (CSIC I+D 2012).
Publicaciones
vacio
2022
- Fabregat M, Niño-Rivero S, Pose S, Cárdenas-Rodríguez M, Bresque M, Hernández K, et al. (2022) Generation and characterization of Ccdc28b mutant mice links the Bardet-Biedl associated gene with mild social behavioral phenotypes. PLoS Genet 18(6): e1009896. https://doi.org/10.1371/journal.pgen.1009896
2018
- Iyer J, Singh MD, Jensen M, Patel P, Pizzo L, Huber E, Koerselman H, Weiner AT, Lepanto P, Vadodaria K, Kubina A, Wang Q, Talbert A, Yennawar S, Badano J, Manak JR, Rolls MM, Krishnan A, Girirajan S (2018) Pervasive genetic interactions modulate neurodevelopmental defects of the autism-associated 16p11.2 deletion in Drosophila melanogaster. Nat Commun 9:2548.
- Novas R, Cardenas-Rodriguez M, Lepanto P, Fabregat M, Rodao M, Fariello MI, Ramos M, Davison C, Casanova G, Alfaya L, Lecumberry F, González-Sapienza G, Irigoín F, Badano JL (2018) Kinesin 1 regulates cilia length through an interaction with the Bardet-Biedl syndrome related protein CCDC28B. Sci Rep 8:3019.
2017
- Prieto-Echagüe V, Lodh S, Colman L, Bobba N, Santos L, Katsanis N, Escande C, Zaghloul NA, Badano JL (2017) BBS4 regulates the expression and secretion of FSTL1, a protein that participates in ciliogenesis and the differentiation of 3T3-L1. Scientific Reports 7(1): 9765.
2016
- Lepanto P, Badano JL, Zolessi FR (2016) Neuron’s little helper: The role of primary cilia in neurogenesis. Neurogenesis (Austin) 3:e1253363.
- Torrado B, Graña M, Badano JL, Irigoín F (2016) Ciliary Entry of the Hedgehog Transcriptional Activator Gli2 Is Mediated by the Nuclear Import Machinery but Differs from Nuclear Transport in Being Imp-α/β1-Independent. PLoS One 11:e0162033.
- Lepanto P, Davison C, Casanova G, Badano JL, Zolessi FR (2016) Characterization of primary cilia during the differentiation of retinal ganglion cells in the zebrafish. Neural Dev 11:10.
2015
- Novas R, Cardenas-Rodriguez M, Irigoín F, Badano JL (2015) Bardet-Biedl syndrome: Is it only cilia dysfunction? FEBS Lett 589:3479-91.
2014
- Shigunov P, Sotelo-Silveira J, Stimamiglio MA, Kuligovski C, Irigoín F, Badano JL, Munroe D, Correa A, Dallagiovanna B (2014) Ribonomic analysis of human DZIP1 reveals its involvement in ribonucleoprotein complexes and stress granules. BMC Mol Biol 15:12.
- Leitch CC, Lodh S, Prieto-Echagüe V, Badano JL, Zaghloul NA (2014) Basal body proteins regulate Notch signaling through endosomal trafficking. J Cell Sci 127:2407-19.
2013
- Cardenas-Rodriguez M, Irigoín F, Osborn DP, Gascue C, Katsanis N, Beales PL, Badano JL (2013) The Bardet-Biedl syndrome-related protein CCDC28B modulates mTORC2 function and interacts with SIN1 to control cilia length independently of the mTOR complex. Hum Mol Genet 22:4031-42.
- Cardenas-Rodriguez M, Osborn DP, Irigoín F, Graña M, Romero H, Beales PL, Badano JL (2013) Characterization of CCDC28B reveals its role in ciliogenesis and provides insight to understand its modifier effect on Bardet-Biedl syndrome. Hum Genet 132:91-105.
2012
- Gascue C, Tan PL, Cardenas-Rodriguez M, Libisch G, Fernandez-Calero T, Liu YP, Astrada S, Robello C, Naya H, Katsanis N, Badano JL (2012) Direct role of Bardet-Biedl syndrome proteins in transcriptional regulation. J Cell Sci 125:362-75.
2011
- Irigoín F, Badano JL (2011) Keeping the balance between proliferation and differentiation: the primary cilium. Curr Genomics 12:285-97
- Gascue C, Katsanis N, Badano JL (2011) Cystic diseases of the kidney: ciliary dysfunction and cystogenic mechanisms. Pediatr Nephrol 26:1181-95
2010
- Zaghloul NA, Liu Y, Gerdes JM, Gascue C, Oh EC, Leitch CC, Bromberg Y, Binkley J, Leibel RL, Sidow A, Badano JL, Katsanis N (2010) Functional analyses of variants reveal a significant role for dominant negative and common alleles in oligogenic Bardet-Biedl syndrome. Proc Natl Acad Sci U S A 107:10602-7.
2009
- Cardenas-Rodriguez M, Badano JL (2009) Ciliary biology: understanding the cellular and genetic basis of human ciliopathies. Am J Med Genet C Semin Med Genet 151C:263-80.
- de Pontual L, Zaghloul NA, Thomas S, Davis EE, McGaughey DM, Dollfus H, Baumann C, Bessling SL, Babarit C, Pelet A, Gascue C, Beales P, Munnich A, Lyonnet S, Etchevers H, Attie-Bitach T, Badano JL, McCallion AS, Katsanis N, Amiel J (2009) Epistasis between RET and BBS mutations modulates enteric innervation and causes syndromic Hirschsprung disease. Proc Natl Acad Sci U S A 106:13921-6.
2008
- Leitch CC, Zaghloul NA, Davis EE, Stoetzel C, Diaz-Font A, Rix S, Alfadhel M, Lewis RA, Eyaid W, Banin E, Dollfus H, Beales PL, Badano JL, Katsanis N (2008) Hypomorphic mutations in syndromic encephalocele genes are associated with Bardet-Biedl syndrome. Nat Genet 40:443-8.
2007
- Gerdes JM, Liu Y, Zaghloul NA, Leitch CC, Lawson SS, Kato M, Beachy PA, Beales PL, DeMartino GN, Fisher S, Badano JL, Katsanis N (2007) Disruption of the basal body compromises proteasomal function and perturbs intracellular Wnt response. Nat Genet 39:1350-60.
- Dawe HR, Smith UM, Cullinane AR, Gerrelli D, Cox P, Badano JL, Blair-Reid S, Sriram N, Katsanis N, Attie-Bitach T, Afford SC, Copp AJ, Kelly DA, Gull K, Johnson CA (2007) The Meckel-Gruber Syndrome proteins MKS1 and meckelin interact and are required for primary cilium formation. Hum Mol Genet 16:173-86.
2006
- Badano JL, Katsanis N (2006) Life without centrioles: cilia in the spotlight. Cell 125:1228-30.
- Badano JL, Mitsuma N, Beales PL, Katsanis N (2006) The ciliopathies: an emerging class of human genetic disorders. Annu Rev Genomics Hum Genet 7:125-48.
- Stoetzel C, Laurier V, Davis EE, Muller J, Rix S, Badano JL, Leitch CC, Salem N, Chouery E, Corbani S, Jalk N, Vicaire S, Sarda P, Hamel C, Lacombe D, Holder M, Odent S, Holder S, Brooks AS, Elcioglu NH, Silva ED, Rossillion B, Sigaudy S, de Ravel TJ, Lewis RA, Leheup B, Verloes A, Amati-Bonneau P, Mégarbané A, Poch O, Bonneau D, Beales PL, Mandel JL, Katsanis N, Dollfus H (2006) BBS10 encodes a vertebrate-specific chaperonin-like protein and is a major BBS locus. Nat Genet 38:521-4.
- Badano JL, Leitch CC, Ansley SJ, May-Simera H, Lawson S, Lewis RA, Beales PL, Dietz HC, Fisher S, Katsanis N (2006) Dissection of epistasis in oligogenic Bardet-Biedl syndrome. Nature 439:326-30.