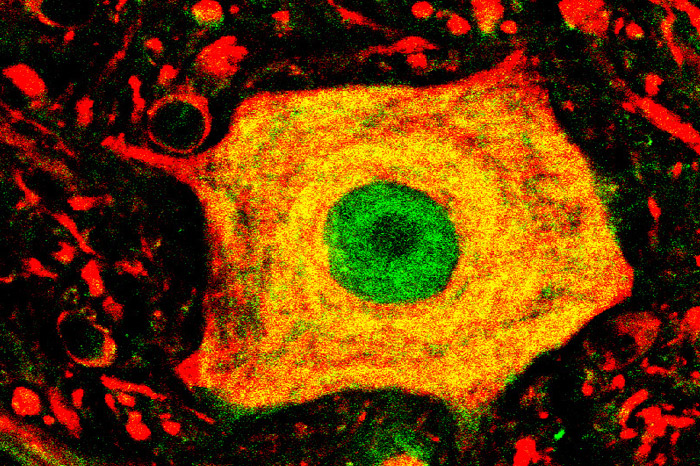
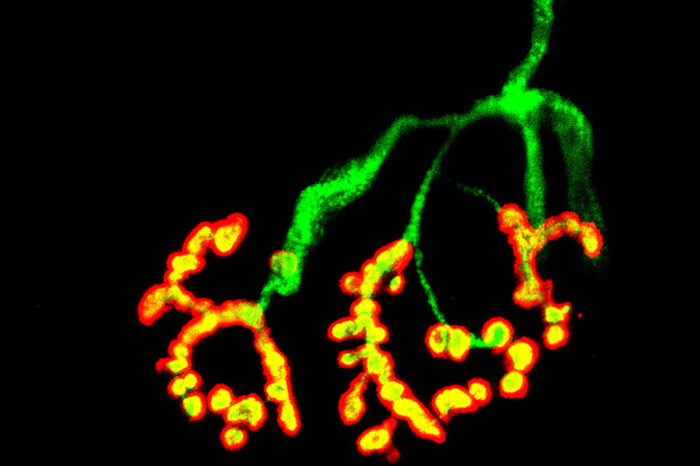
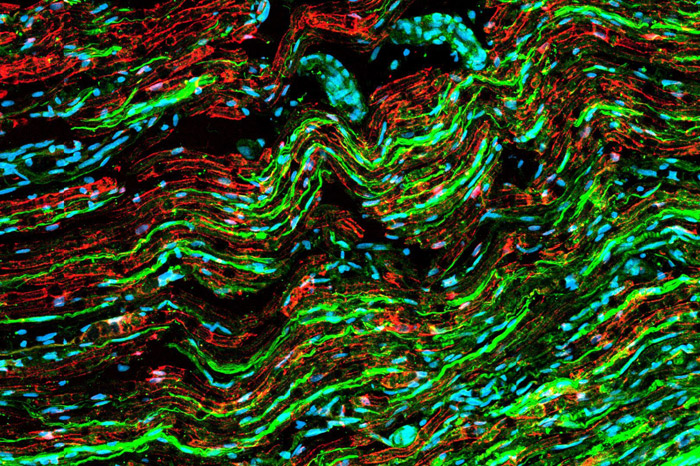
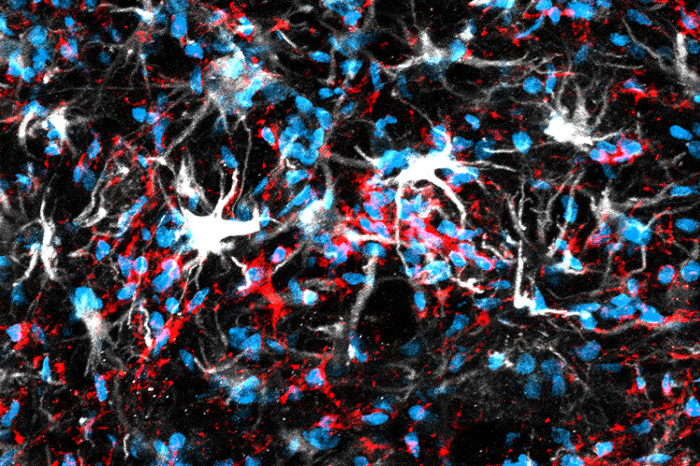
Neurodegeneración
En la mayoría de las enfermedades neurodegenerativas como la Enfermedad de Alzheimer, Enfermedad de Parkinson y la Esclerosis Lateral Amiotrófica (ELA), la patología neuronal comienza como un proceso focal que se extiende a otras regiones cerebrales.
Nuestra investigación apunta a comprender los mecanismos biológicos que subyacen a la progresión del proceso neurodegenerativa en un modelo de ELA. Asimismo, nuestra investigación apunta al desarrollo de fármacos para detener la progresión de la enfermedad, lo que permitiría una mejora significativa en la calidad de vida de los pacientes.
La aproximación experimental se basa en caracterizar el “microambiente celular” neurodegenerativo, desentrañando el papel de las neuronas, células gliales así como células inmunes y vasculares. Se identifican nuevos tipos celulares con fenotipo aberrante así como nuevos mediadores proteicos y receptores que promueven el proceso degenerativo y que puedan ser blanco de fármacos específicos.
Los resultados de estos estudios impactarán en una mejor comprensión, diagnóstico y tratamiento de las enfermedades neurodegenerativas.
Integrantes






Líneas de investigación
Caracterización de fenotipos aberrantes de células gliales durante en la ELA.
Influencia de mastocitos y neutrófilos en la degeneración de neuronas motoras y pérdida de sinápsis neuromusculres.
Desarrollo de nuevos fármacos moduladores de la neuroinflamación para el tratamiento de la ELA
Nitro-NGF como un nuevo factor glial que media la apoptosis de la neurona motora.
Proyectos
2016-2017 – Contratos de investigación para desarrollo de fármacos para la ELA (Megapharma, Uruguay y AbScience, Francia).
2015-2017 – Proyecto ECOS U014S02 “Mastocitos y neuroinflamación en enfermedades neurodegenerativas: caracterización de los mecanismos implicados y nuevos blancos terapéuticos”.
2013-2014 – Fondo Clemente Estable ANII. FCE_1_2011_1_7342. Astrocitos fenotípicamente Aberrantes (células AbA): identificación de mecanismos y genes neurotóxicos. Amount granted aprox USD 40.000.
Publicaciones
vacio
2018
- Olivera-Bravo S, Seminotti B, Isasi E, Ribeiro CA, Leipnitz G, Woontner M, Goodman SI, Souza D, Barbeito L, Wajner M. Long Lasting High Lysine Diet Aggravates White Matter Injury in Glutaryl-CoA Dehydrogenase Deficient (Gcdh-/-) Mice. Mol Neurobiol. 2018
- Kim MJ, Vargas MR, Harlan BA, Killoy KM, Ball LE, Comte-Walters S, Gooz M, Yamamoto Y, Beckman JS, Barbeito L, Pehar M. Nitration and Glycation Turn Mature NGF into a Toxic Factor for Motor Neurons: A Role for p75(NTR) and RAGE Signaling in ALS. Antioxid Redox Signal. 2018, 28(18):1587-1602.
2017
- Trias E., Ibarburu S., Barreto-Nuñez R., Varela V., Moura I.C., Dubreuil P., Hermine O., Beckman S.J., Barbeito L.. Evidence for mast cells contributing to neuromuscular pathology in an inherited model of ALS. Journal of Clinical Investigation-Insight. 20172(20):e95934
- Ibarburu S, Trias E., Lago N, Barreto-Nuñez R, Varela V, Beckman SJ, Barbeito L. 2017. Focal Transplantation of Aberrant Glial Cells Carrying the SOD1G93A Mutation into Rat Spinal Cord Induces Extensive Gliosis. Neuroimmunomodulation. 24(3):143-153
- Trias E., Ibarburu S., Barreto-Núñez R., Barbeito L. 2017. Significance of aberrant glial cell phenotypes in pathophysiology of amyotrophic lateral sclerosis. Neuroscience Letters. 636:27-31. Review.
- Jiménez-Riani M., Díaz-Amarilla P., Isasi E., Casanova G., Barbeito L., Olivera-Bravo S. 2017. Ultrastructural features of aberrant glial cells isolated from the spinal cord of paralytic rats expressing the amyotrophic lateral sclerosis-linked SOD1G93A mutation. Cell and Tissue Research. 1(11)
2016
- Williams, J.R., Trias, E., Beilby, P.R., Lopez, N.I., Labut, E.M., Bradford, C.S., Roberts, B.R., McAllum, E.J., Crouch, P.J., Rhoads, T.W., et al. 2016. Copper delivery to the CNS by CuATSM effectively treats motor neuron disease in SOD mice co-expressing the Copper-Chaperone-for-SOD. Neurobiol Dis 89:1-9.
- Trias, E., et al., Post-paralysis tyrosine kinase inhibition with masitinib abrogates neuroinflammation and slows disease progression in inherited amyotrophic lateral sclerosis. J Neuroinflammation, 2016. 13(1): p. 177.
- Diaz-Amarilla P, Miquel E, Trostchansky A, Trias E, Ferreira AM, Freeman BA, Cassina P, Barbeito L, Vargas MR, Rubbo H. Electrophilic nitro-fatty acids prevent astrocyte-mediated toxicity to motor neurons in a cell model of familial amyotrophic lateral sclerosis via nuclear factor erythroid 2-related factor activation. Free Radic Biol Med. 2016 95:112-20.
- Villarreal A, Rosciszewski G, Murta V, Cadena V, Usach V, Dodes-Traian MM, Setton-Avruj P, Barbeito LH, Ramos AJ. Isolation and Characterization of Ischemia-Derived Astrocytes (IDAs) with Ability to Transactivate Quiescent Astrocytes. Front Cell Neurosci. 2016; 10:139.
2015
- Olivera-Bravo S, Ribeiro CA, Isasi E, Trías E, Leipnitz G, Díaz-Amarilla P, Woontner M, Beck C, Goodman SI, Souza D, Wajner M, Barbeito L. Striatal neuronal death mediated by astrocytes from the Gcdh-/- mouse model of glutaric acidemia type I. Hum Mol Genet. 2015; 24(16):4504-15.
- Olivera-Bravo, S., and Barbeito, L. A role of astrocytes in mediating postnatal neurodegeneration in Glutaric acidemia-type 1. FEBS Lett 2015, 589:3492-3497.
2014
- Miquel E, Cassina A, Martínez-Palma L, Souza JM, Bolatto C, Rodríguez-Bottero S, Logan A, Smith RA, Murphy MP, Barbeito L, Radi R, Cassina P. Neuroprotective effects of the mitochondria-targeted antioxidant MitoQ in a model of inherited amyotrophic lateral sclerosis. Free Radic Biol Med. 2014, 70:204-13.
- Richter M, Varela V, Trias E, Barbeito L. (2014). “Post-translational modification of nerve growth factor by peroxynitrite: pathogenic significance in neurodegenerative diseases”. European Journal of neurodegenerative diseases, 2014 Dec; Vol 3.
- Olivera-Bravo S, Isasi E, Fernández A, Rosillo JC, Jiménez M, Casanova G, Sarlabós MN, Barbeito L. White matter injury induced by perinatal exposure to glutaric acid. Neurotox Res. 2014, 25(4):381-91.
2013
- Trias E, Díaz-Amarilla P, Olivera-Bravo S, Isasi E, Drechsel DA, Lopez N, Bradford CS, Ireton KE, Beckman JS, Barbeito L. Phenotypic transition of microglia into astrocyte-like cells associated with disease onset in a model of inherited ALS. Front Cell Neurosci. 2013; 7:274.
- Gandelman M, Levy M, Cassina P, Barbeito L, Beckman JS. P2X7 receptor-induced death of motor neurons by a peroxynitrite/FAS-dependent pathway. J Neurochem. 2013, 126:382-8.
- Seminotti B, Amaral AU, da Rosa MS, Fernandes CG, Leipnitz G, Olivera-Bravo S, Barbeito L, Ribeiro CA, de Souza DO, Woontner M, Goodman SI, Koeller DM, Wajner M. Disruption of brain redox homeostasis in glutaryl-CoA dehydrogenase deficient mice treated with high dietary lysine supplementation. Mol Genet Metab. 2013, 108(1):30-9.
2012
- Miquel E, Cassina A, Martínez-Palma L, Bolatto C, Trías E, Gandelman M, Radi R, Barbeito L, Cassina P. Modulation of astrocytic mitochondrial function by dichloroacetate improves survival and motor performance in inherited amyotrophic lateral sclerosis. PLoS One. 2012; 7(4):e34776.
- Drechsel DA, Estévez AG, Barbeito L, Beckman JS. Nitric oxide-mediated oxidative damage and the progressive demise of motor neurons in ALS. Neurotox Res. 2012 Nov; 22(4):251-64.
2011
- Díaz-Amarilla P, Olivera-Bravo S, Trias E, Cragnolini A, Martínez-Palma L, Cassina P, Beckman J, Barbeito L. Phenotypically aberrant astrocytes that promote motoneuron damage in a model of inherited amyotrophic lateral sclerosis. Proc Natl Acad Sci U S A. 2011; 108(44):18126-31.
- Olivera-Bravo S, Fernández A, Sarlabós MN, Rosillo JC, Casanova G, Jiménez M, Barbeito L. Neonatal astrocyte damage is sufficient to trigger progressive striatal degeneration in a rat model of glutaric acidemia-I. PLoS One. 2011; 6(6):e20831.
2010
- Garré JM, Retamal MA, Cassina P, Barbeito L, Bukauskas FF, Sáez JC, Bennett MV, Abudara V. FGF-1 induces ATP release from spinal astrocytes in culture and opens pannexin and connexin hemichannels. Proc Natl Acad Sci U S A. 2010, 107(52):22659-64.
- Gandelman M, Peluffo H, Beckman JS, Cassina P, Barbeito L. Extracellular ATP and the P2X7 receptor in astrocyte-mediated motor neuron death: implications for amyotrophic lateral sclerosis. J Neuroinflammation. 2010 Jun 9; 7:33.
- Barbeito AG, Martinez-Palma L, Vargas MR, Pehar M, Mañay N, Beckman JS, Barbeito L, Cassina P. Lead exposure stimulates VEGF expression in the spinal cord and extends survival in a mouse model of ALS. Neurobiol Dis. 2010; 37(3):574-80.