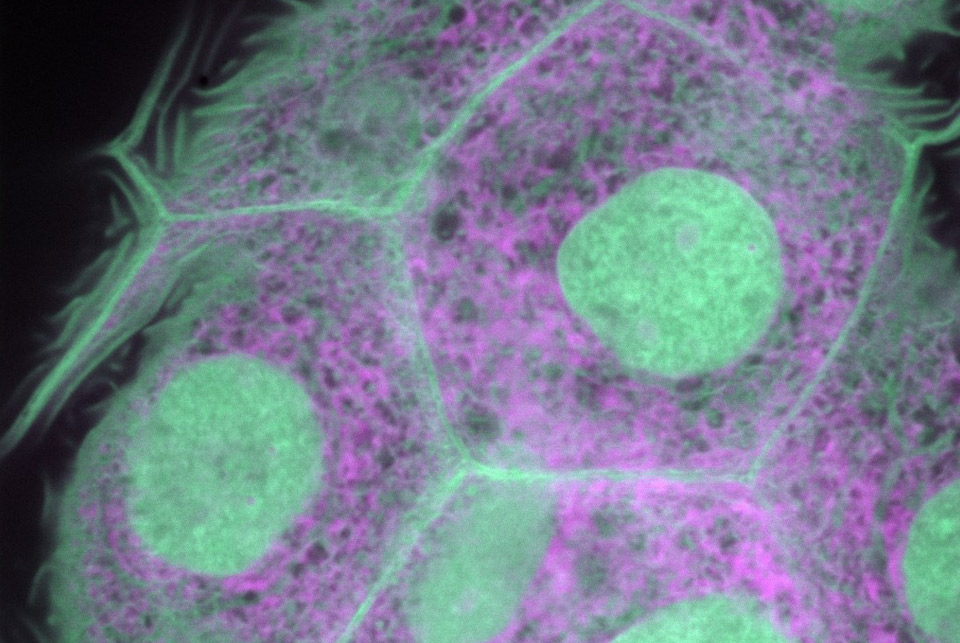
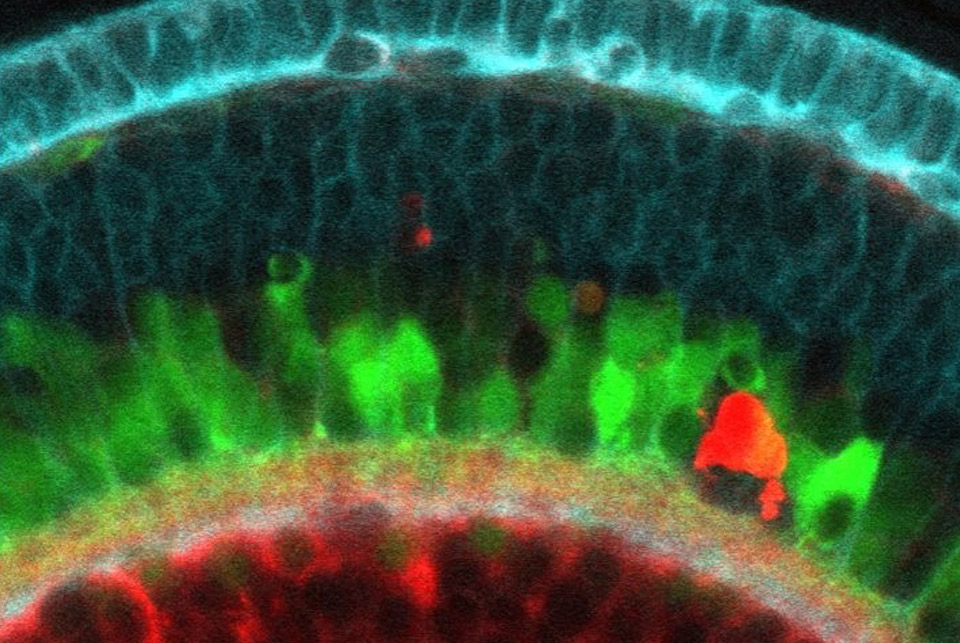
Bioimagenología Avanzada
La Unidad de Bioimagenología Avanzada (UBA) es una unidad mixta entre la Universidad de la República y el Institut Pasteur de Montevideo. Nos apasiona el desarrollo de nuevo hardware y métodos de microscopía, además de que tenemos un fuerte compromiso con la diseminación de nuestras herramientas. En la UBA ofrecemos a la región talleres de microscopía gratuitos sobre técnicas y métodos avanzados, así como también cursos prácticos de análisis y fundamentos de microscopía para principiantes.
El personal de microscopistas expertos de la UBA tiene sólida experiencia en el apoyo a los usuarios en el diseño, ejecución y resolución de problemas de experimentos de microscopía, y damos servicios siguiendo los estándares internacionales de buenas prácticas. El portafolio de microscopía de la UBA incluye instrumentos de epifluorescencia, láser confocal, así como instrumentos multifotón “hechos a la medida”. Nuestros microscopios pueden realizar experimentos hasta en 5D (x / y / z / t / λ o τ). Entre las herramientas que dominamos en la UBA se destacan técnicas como FLIM, FRET, graficos de fasores, autofluorescencia, generación de armónicos, imágenes de tejido profundo, FCS y relacionadas, entre otras.
Integrantes









Bruno Pannunzio, PhD


Micaela Lopassio, Ing
Estudiante honoraria de maestría
Hospital de Clínicas, Udelar
mlopassio@pasteur.edu.uy
Líneas de investigación
Buscamos brindar acceso público a servicios de bioimagen de alta calidad, y desarrollar instrumentación, métodos y aplicaciones en biofotónica y bioimagen focalizados en las ciencias de la vida y más específicamente enfocados en la investigación biomédica.
Investigación impulsada por la tecnología (TDR): instrumentos y métodos de vanguardia.
Herramientas y métodos de obtención de imágenes de espectroscopia para la obtención de imágenes metabólicas in vivo utilizando enfoques sin etiquetas.
Desarrollo y aplicación de métodos basados en gráficos de fasores para imágenes de fluorescencia hiperespectral y de por vida.
Proyecto impulsado por la biología (BDP): fuertemente apoyado por colaboraciones (intra e interinstitucionales).
Dinámica del agua in vivo mediante sondas e imágenes DAN. Foco en enfermedades neurodegenerativas y separación de fases líquidas.
Firmas metabólicas basadas en moléculas de autofluorescencia para patología de imagen.
Equipos principales
EQUIPOS COMERCIALES EN SERVICIO
Microscopía epifluorescente:
Microscopio de Epifluorescencia Olympus IX81: microscopio invertido con iluminación Halógena y de Mercurio que cuenta con una cámara monocromática Hamamatsu ORCA ER para la adquisición de imágenes de fluorescencia y luz transmitida de muy buena calidad.
Aplicaciones:
- Observaciones de portaobjetos, placas de petri, botellas y otros tipos de muestras marcadas con moléculas fluorescentes.
- Observaciones de preparados en campo claro, contraste de fases y DIC (Nomarski).
- Toma de imágenes con cámara monocromática ORCA ER Hamamatsu.
Microscopía confocal:
Confocal Zeiss LSM800: microscopio de epifluorescencia invertido Axio Observer Z1 acoplado a módulo confocal LSM800. Se trata de un confocal básico semi-espectral que permite adquirir imágenes confocales fluorescentes de alta resolución en una gran variedad de muestras. Además cuenta con una cámara monocromática AxioCam 506 para obtener imágenes de fluorescencia, campo claro o DIC en forma paralela.
Aplicaciones:
- Adquisición de imágenes confocales de muestras fluorescentes en un plano o en profundidad.
- Toma de imágenes con luz transmitida y DIC que se pueden combinar con fluorescencia.
- Adquisición de imágenes fluorescentes, campo claro o DIC con cámara monocromática de alta velocidad.
- Realización de experimentos que impliquen toma de imágenes de varias posiciones en 2D o 3D, reconstrucciones de tipo mosaico, time-lapse, barrido semi-espectral entre otras.
Confocal Zeiss LSM880: microscopio de epifluorescencia invertido Axio Observer 7 acoplado a módulo confocal LSM880. Es un confocal espectral que cuenta con un detector de alta sensibilidad GaAsP. Se pueden obtener imágenes fluorescentes o de luz transmitida con DIC de excelente definición. Se trata de un instrumento equipado con cámara de incubación con temperatura y C02 controlado para experimentos in vivo.
Aplicaciones:
- Adquisición de imágenes confocales de muestras fluorescentes en un plano o en un volumen.
- Toma de imágenes con luz transmitidas y DIC que se pueden combinar con fluorescencia.
- Realización de experimentos que impliquen toma de imágenes de varias posiciones en 2D o 3D, reconstrucciones de tipo mosaico, time-lapse, barrido semi-espectral entre otras.
- Realización de experimentos con muestras vivas por largos períodos de tiempo con estabilización de foco.
- Adquisiciones espectrales.
- Espectroscopía de correlación de fluorescencia (FCS).
COMPUTADORAS PARA PROCESAMIENTO DE IMÁGENES
Sala de computadoras UBA-IPMONT:
UBA02 (IPMONT):
- Pantalla 22” y 28”.
- Procesador i5.
- RAM 16 GB.
- Programas de análisis: , Fiji & ImageJ (NIH, Bethesda-USA), SimFCS for images (G-Soft, Ilinois-USA)/Zen Lite blue-black (Carl Zeiss Microscopy, Munich-Germany).
UBA03 (IPMONT):
- Pantalla 28” y Monitor interactivo para dibujar, XP-PEN Artist 22E Pro 21.5”.
- Procesador i7.
- RAM 64 GB.
- Programas de análisis: , Fiji & ImageJ (NIH, Bethesda-USA), SimFCS for images (G-Soft, Ilinois-USA)/Zen Lite blue-black (Carl Zeiss Microscopy, Munich-Germany).
Sala de computadoras UBA-HC:
PC-1 (HC):
- Intel Core i7-3779 CPU @ 3.40HGHz.
- 32Gb DDR3 RAM.
- 128GB SSD, Disco duro SATA 1Tb.
- Tarjeta de video NVIDIA GeForce GT 640 DDR3 2Gb.
- 2 monitores BenQ GL2450 26 pulgadas.
PC-2 (HC):
- CPU INTEL CORE I7 9700 (3.0Ghz) 12MB Socket 1151.
- 64Gb DDR3 RAM.
- HD SSD 240GB KINGSTON, HD. 1TB SATA6.
- 2 monitores MONITOR LED 27″ ACER Nitro VG270 IPS 144Hz FULL HD.
Servidor de datos NAS SYNOLOGY DS920+ DESKTOP (4 BAHIAS) con 40TB de datos.
Software para análisis y procesamiento de imágenes:
- SimFCS for images (G-Soft, Ilinois-USA), Fiji & ImageJ (NIH, Bethesda-USA), Icy (Pasteur Paris, France) y código/rutinas customizadas en MatLab (MathWorks).
Equipos de taller y dispositivos de medida (IPMONT):
- Impresora 3D – Comgrow Creality Ender 3 Pro.
- Torno para metal Grizzly G0602 – 10″ x 22″.
- Fresadora para metal HiTorque Mini Mill, Deluxe (LittleMachineShop.com).
- Accesorios para fresadora y torno (morza para ángulos y rotatoria).
- Estación de soldadura de aire caliente °F /°C con múltiples funciones YIHUA 862BD+SMD ESD.
- Compact Power and Energy Meter Console, Digital 4″ LCD + Microscope Slide Thermal Power Sensor, 300 nm – 10.6 μm, 2 W.
- Osciloscopio digital Tektronix TDS784A (4 canales 1GHz).
- Espectrómetros de alta resolución y velocidad para diffuse optical spectroscopic imaging (DOSI) . HR4000 y 2x USB200 (Ocean Optics).
EQUIPOS EN DESARROLLO
Instrumento basado en fibras ópticas para medidas de tiempo de vida y espectral. Detector Hamamatsu de 2×2, A320 fastFLIMbox (ISS), Láser Diodo 370 nm modulado hasta 300MHz (ISS), Fibras ópticas (ThorLabs).
Microscopio «home-buit» de dos fotones con resolución de tiempo de vida y FCS. Bloque epifluorescencente Nikon Ti-S, laser pulsado basado en fibra 780 nm (Calmar), 3 detectores pesudo conteo de fotones (GaAsP Hamamatsu), FLIMBox 320 (ISS), platina motorizada x/y (ASI), lente eléctrico (Optotune), CO2 y temperatura controlada, mesa óptica con aislación pasiva (TMC) escáner galvanométrico x/y (Cambridge Technologies).
- FLIM
- FRET
- Phasor plots
- FCS (single point, line, circular, diffusion map)
- RICS (crossRICS)
- N&B (crossN&B)
- pCF (pCOMB)
- 2D y 2D Particle Tracking
- Epifluorescence (camera based)
Microscopio 2-fotones con detector DIVER (1 o 4 canales) + 2 detectores no escaneados para epifluorescencia (deep tissue/intravital imaging). Láser pulsado sintonizable (690-1040) Ti-Zafiro MaiTai eHP DeepSee (Spectra-Physics), óptica de escaneo de 2 pulgadas, 2 detectores pesudo conteo de fotones + detector DIVER customizado (GaAsP Hamamatsu), FLIMBox Kintex (FLIM Labs), platina motorizada x/y/z (ASI), lente eléctrico (Optotune), mesa óptica con aislación pasiva (NewPort), escáner galvanométrico x/y (Cambridge Technologies).
- FLIM
- FRET
- Phasor plots
- FCS (single point, line, circular, diffusion map)
- RICS (crossRICS)
- N&B (crossN&B)
- pCF (pCOMB)
- 2D y 2D Particle Tracking
- Detección espectral (filtros seno/coseno)
Cursos
- 1º Annual Workshop on Advanced Microscopy and Biophotonics. 25 – 28 de noviembre de 2019. Unidad de Microscopía Avanzada y Bifotónica, Hospital de Clínicas – Universidad de la República. Organizador: Malacrida, Leonel.
- 2º Annual Workshop on Advanced Microscopy and Biophotonics. 23 – 27 de noviembre de 2020. Institut Pasteur de Montevideo / Universidad de la República. Organizador: Malacrida, Leonel.
Entrenamiento de usuarios:
- Uso básico de instrumentos de microscopía fluorescente (uno a uno). Díaz, Marcela.
- Manejo, almacenamiento y análisis de datos básicos mediante software gratuito (uno a uno). De los Campos, Tabaré.
Proyectos
1- Proyectos impulsados por el desarrollo de tecnología, métodos y aplicaciones en el campo de la Biofotónica/Technological Driven projects.
a) «Desarrollo y puesta punto de un nuevo dispositivo basado en fibras ópticas con resolución de tiempo de vida y espectral para la evaluación metabólica tisular in vivo por la autofluorescencia.»financiado por CSIC I+D 2021-2023. PI: Leonel Malacrida. ~40K (U$S)
b) “Microscopia de dos fotones resuelta en el tiempo de vida en el Hospital Universitario: un microscopio en el estado de arte para responder preguntas en biomedicina.”, financiado por CSIC Equipamiento pesado 2018. PI’s: Leonel Malacrida y Javier Hurtado. $U 3.850.000
c) «Desarrollo de un dispositivo óptico para el diagnóstico rápido y portable de SARS-CoV2 con proteínas ingenierizadas»,financiado por Fundación Manuel Pérez, Llamado especial Corona virus 2019. PIs: Leonel Malacrida y Sergio Pantano (IPMON) U$S 30k
d) “Fluorescence Lifetime Assisted in vivo Detection of Skin Cancers with a Portable Point-of-Care Fiber Optical Device.”, financiación NIH P41-GM103540. PI’s: Leonel Malacrida y Enrico Gratton. U$S 50000
e) “Ver profundo: un láser pulsado y sintonizable para bucear en la profundidad del tejido” , financiado por ANII, Llamado PEC_3_2019_1_159349. PI: Leonel Malacrida U$S 120k
2- Proyectos biológicos «guiados por curiosidad»/ Biological Driven Projects.
a) “Una aproximación a las enfermedades neurodegenerativas mediante microscopía y espectroscopia de fluorescencia in vivo. Rol de la segregación de fases líquido-líquido en la fisio(pato)logía celular.”, financiado por FCE Mod II 2018-ANII. PI: Leonel Malacrida. $U 1.000.000
b) “Microscopía no-lineal y por tiempo de vida en modelos experimentales de lesión pulmonar: Evaluación de su utilidad diagnóstica a través de aprendizaje automático”,financiado por CSIC I+D 2018. PI: Leonel Malacrida. $U 1.000.000
c) “Exploring mechanisms of circadian regulation of cell metabolism in the skin: implications for exposome-induced skin aging and carcinogenesis”,financiado por Exposome Grant Vichy 2021. PI: Andres Kamaid. U$S 5.000
3- Proyectos de Extensión o desarrollo institucional/Institutional and social projects.
a) «Cooperación para el desarrollo de capacidades en microscopía avanzada con miras a cooperación para el desarrollo de capacidades en microscopía avanzada con miras a constituir la red latinoamericana de microscopía», Financiado por el Fondo conjunto de cooperación México-Uruguay (AMEXCID-AUCI). Responsables: Andres Kamaid (IPMON), Christopher Wood (UNAM), Leonel Malacrida (UdelaR). U$S100.000
b)«Desarrollo de una Unidad de Bioimagenología Avanzada en Latinoamerica». Financiado por Chan Zuckerberg Initiativeen su programa «Imaging Scientist» Ciclo 2 – 2020 (la UBA es un esfuerzo mixto de la Universidad de la República y el Institut Pasteur de Montevideo). PI: Leonel Malacrida. U$S 370.000 (5 años).
Proyectos colaborativos con participación de integrantes de la UBA:
- R. Duran FCE 2019_ANII “Elongasoma y divisoma de Corynebacterineae”
- P. Grille & H. Peluffo FSS 2019_ANII “Monitoreo del paciente neurocrítico”
- L. Thompson & M. Moller FMV 2019_ANII “Conservación de hemocomponentes para transfusión”
- R. Cantera & D. Prieto FCE 2019_ANII “Percepción de oxígeno en el cerebro de Drosophila melanogaster”
- S. Pantano Coronavirus Task Force-IP-Paris 2020 ”isCoVDe: Engineering an ACE2 derived polypeptide for label-free detection”
- F. Irigoín & M. Cruces & J. Badano (Histology Fmed-IPMont) CSIC I+D 2020 “Primary cilia organization and dynamics”
— F. Zolessi (FCIEN&IPMON) CSIC I+D 2020
— C. Quijano (FMED) CSIC I+D 2020 - F. Cuadro & A. Menchaca (FVet) “Estradiol distribution in the sheep ovary ”
- J. Badano & P. Lepanto (IPMont) “Lipid metabolimsm & accumulation in ZF model”
- M. Seijas & S. Gortarri ·& A. Alcantara (Nephrology-HC) “Kindny transplant intravital imaging”
- F. Blasina & T. Galiardi (Neonatology-HC) ”Mechanical ventialation for Lung surfactant selection”
- L. Amarelle & J. Hurtado (Physiopathology-HC-H.Español) ”Intravital imaging & oxygen therapy”
- M. Comini & M. Bolati (IPMont) ”Redox sensors and FLIM/hyperspectral imaging”
- M. Nieves & A. Buschiazzo (IPMont) ”Bacterial membrane organization & Temp shock”
- J. Magliano & S. Martinez (Dermatology) ”Skin carcinoma and label-free methabolic imaging”
Publicaciones
vacio
2022
- Villar SF, Dalla-Rizza J, Möller MN, Ferrer-Sueta G, Malacrida L, Jameson DM, Denicola A. Fluorescence Lifetime Phasor Analysis of the Decamer-Dimer Equilibrium of Human Peroxiredoxin 1. Int J Mol Sci. 2022 May 9;23(9):5260. doi: 10.3390/ijms23095260.
- Vorontsova I, Vallmitjana A, Torrado B, Schilling TF, Hall JE, Gratton E, Malacrida L. In vivo macromolecular crowding is differentially modulated by aquaporin 0 in zebrafish lens: Insights from a nanoenvironment sensor and spectral imaging. Sci Adv. 2022 Feb 18;8(7):eabj4833. doi: 10.1126/sciadv.abj4833.
- Torrado B, Malacrida L, Ranjit S. Linear Combination Properties of the Phasor Space in Fluorescence Imaging. Sensors (Basel). 2022 Jan 27;22(3):999. doi: 10.3390
2021
- Irene Vorontsova, Alexander Vallmitjana, Belén Torrado, Thomas Schilling, James E. Hall, Enrico Gratton, Leonel Malacrida. (2021) In vivo macromolecular crowding is differentially modulated by Aquaporin 0 in zebrafish lens: insights from a nano-environment sensor and spectral imaging. bioRxiv 2021.05.15.442187; doi: https://doi.org/10.1101/2021.05.15.442187
- Hedde PN, Cinco R, Malacrida L, Kamaid A, Gratton E (2021). Phasor-based hyperspectral snapshot microscopy allows fast imaging of live, three-dimensional tissues for biomedical applications. Commun Biol. 2021 Jun 11;4(1):721. doi: 10.1038/s42003-021-02266-z.
- Lepanto P, Levin-Ferreyra F, Koziol U, Malacrida L, Badano JL (2021). Insights into in vivo adipocyte differentiation through cell-specific labeling in zebrafish. Biol Open. 2021 Sep 15;10(9):bio058734. doi: 10.1242/bio.058734.
- Malacrida L#, Ranjit S#, Jameson DM, Gratton E.Annu Rev Biophys. (2021) The Phasor Plot: A Universal Circle to Advance Fluorescence Lifetime Analysis and Interpretation. 2021 May 6;50:575-593. doi: 10.1146/annurev-biophys-062920-063631. (# primer autor en pie de igualdad)
- Swedlow JR, Kankaanpää P, Sarkans U, Goscinski W, Galloway G, Malacrida L, Sullivan RP, Härtel S, Brown CM, Wood C, Keppler A, Paina F, Loos B, Zullino S, Longo DL, Aime S, Onami S. (2021). A global view of standards for open image data formats and repositories. Nat Methods. 2021 May 4. doi: 10.1038/s41592-021-01113-7
- Amarelle L*, Quintela L, Hurtado J, Malacrida L*. (2021) Hyperoxia and Lungs: What We Have Learned From Animal Models. Front Med (Lausanne). 2021 Mar 9;8:606678. doi: 10.3389/fmed.2021.606678. (* autor correspondiente)
- Gunther G#, Malacrida L#, Jameson DM, Gratton E, Sánchez SA. (2021). LAURDAN since Weber: The Quest for Visualizing Membrane Heterogeneity. Acc Chem Res. 2021 Feb 16;54(4):976-987. doi: 10.1021/acs.accounts.0c00687.
(# primer autor en pie de igualdad) - Hedde PN, Malacrida L, Barylko B, Binns DD, Albanesi JP, Jameson DM. (2021). Membrane Remodeling by Arc/Arg3.1. Front Mol Biosci. 2021 Mar 8;8:630625. doi: 10.3389/fmolb.2021.630625.
2020
- Leonel Malacrida, Per Niklas Hedde, Belen Torrado, Enrico Gratton. (2020) Barriers to diffusion in cells: visualization of membrane-less particles in the nucleus. The Biophysicist (2020) 1 (2): 9.
- Vicente Castro-Castillo, Javier Gajardo, Catalina Sandoval-Altamirano, Enrico Gratton, Susana Sanchez, Leonel Malacrida*, German Gunther*. (2020). CAPRYDAA, an anthracene dye analog to LAURDAN: a comparative study using cuvette and microscopy. Journal of Materials Chemistry B. 2020 Jan 7;8(1):88-99. (* autor correspondiente)
2019
- S Ranjit#, L Malacrida#, M Stakic, E Gratton. (2019) Determination of the metabolic index using the fluorescence lifetime of free and bound nicotinamide adenine dinucleotide using the phasor approach. J Biophotonics 2019 Nov;12(11):e201900156. (# primer autor en pie de igualdad)
- A Dvornikov, L Malacrida, E Gratton. (2019) The DIVER Microscope for Imaging in Scattering Media. Methods and protocols 2 (2), 53. 2019
- Daniel Rodriguez-Agudo, Leonel Malacrida, Genta Kakiyama, Tavis Sparrer, Carolina Fortes, Michael Maceyka, Mark A Subler, Jolene J Windle, Enrico Gratton, William M Pandak, Gregorio Gil. (2019) StarD5: an ER stress protein regulates plasma membrane and intracellular cholesterol homeostasis. Journal of lipid research 60 (6), 1087-1098. 2019
- Jorge Rodriguez‐Duarte, Germán Galliussi, Rosina Dapueto, Jessica Rossello, Leonel Malacrida, Andrés Kamaid, Francisco J Schopfer, Carlos Escande, Gloria V López, Carlos Batthyány. (2019) A novel nitroalkene‐α‐tocopherol analogue inhibits inflammation and ameliorates atherosclerosis in Apo E knockout mice. British journal of pharmacology 176 (6), 757-772. 2019